Tüdő egy mikrochipen
 Az új orvosi eljárások, gyógyszerek kikísérletezése után azok minőségének ellenőrzése, hatásaiknak tesztelése, orvosi forgalomba helyezésük engedélyezése egy igen hosszú és költséges folyamat. Ennek elsődleges oka, hogy a fejlesztés során alkalmazott tesztelési körülmények lényegesen eltérnek a végső felhasználás helyének, vagyis az emberi testnek a jellemzőitől, így a kezdeti bíztató eredményeket számtalan módon meg kell erősíteni a lehetséges kockázatok minimalizálása végett.Sokszor csak a kutatás késői fázisában derül ki, hogy az egész irány téves volt. Egy új technika most lehetővé teszi, hogy egy néhány centiméter méretű mikrochip szerű eszközzel a lehető legélethűbb módon modellezzük szerveinket, így tulajdonképpen „élesben” lehet vizsgálni az új hatóanyagokat mindenféle rizikó nélkül, hihetetlen módon meggyorsítva ezzel a kutatólaborokból a rendelőkig vezető út megtételét.
Az új orvosi eljárások, gyógyszerek kikísérletezése után azok minőségének ellenőrzése, hatásaiknak tesztelése, orvosi forgalomba helyezésük engedélyezése egy igen hosszú és költséges folyamat. Ennek elsődleges oka, hogy a fejlesztés során alkalmazott tesztelési körülmények lényegesen eltérnek a végső felhasználás helyének, vagyis az emberi testnek a jellemzőitől, így a kezdeti bíztató eredményeket számtalan módon meg kell erősíteni a lehetséges kockázatok minimalizálása végett.Sokszor csak a kutatás késői fázisában derül ki, hogy az egész irány téves volt. Egy új technika most lehetővé teszi, hogy egy néhány centiméter méretű mikrochip szerű eszközzel a lehető legélethűbb módon modellezzük szerveinket, így tulajdonképpen „élesben” lehet vizsgálni az új hatóanyagokat mindenféle rizikó nélkül, hihetetlen módon meggyorsítva ezzel a kutatólaborokból a rendelőkig vezető út megtételét.
/Az előadás videója csak angol nyelven érhető el, alatta összefoglaljuk ábrák segítségével az elhangzottakat./
Gondoljunk bele, hogy milyen lehetőségei vannak a tudósoknak egy új hatóanyag vizsgálatára. A legegyszerűbb módszer a Petri-csészébe helyezett sejttenyészetek reakcióinak megfigyelése. Ebben az esetben ugyan lehet látni, hogy önmagukban a megcélzott sejtek miként reagálnak a kezelésre, de a vizsgált sejtek ki vannak szakítva természetes „élőhelyükből”. Egy ilyen mesterséges környezet vajmi kevéssé modellezi az élő szervezetben zajló folyamatokat. Az emberi szervezet ugyanis egy dinamikus rendszer, melyben szinte minden állandó mozgásban van. Az érfalaink ritmusosan tágulnak és összeszűkülnek, a tüdőnk minden belégzés alkalmával térfogat növekedésen esik át, a beleink perisztaltikus mozgást végeznek, és akkor a tudatosan vezérelt izom összehúzódásokat még nem is említettük. Ez a dinamika alapjaiban befolyásolja a testben végbemenő folyamatokat, akár az egyes sejtek szintjén is (erre később látunk majd konkrét példát is). Egy csészében sütkérező sejtcsoport esetében aligha remélhetjük a hasonló folyamatok hatásainak viszontlátását… miként a megannyi különféle típusú sejt kölcsönhatása is hiányzik a modellből.
A másik lehetőséget az állatkísérletek jelentik. Ez nyilván közelebb áll a valósághoz, hiszen legalább egy élő rendszerről beszélünk, de hiába oly sok a hasonlóság saját szervezetünk és egy kisemlős felépítése közt, számtalan alapvető különbség van, amelyek miatt a rágcsálókon végzett tesztek csak egy lépést jelenthetnek a végső siker felé vezető úton.
Az utolsó lépést az embereken való kipróbálás jelenti, eddig a fázisig azonban nagyon lassan jut el a folyamat. Ráadásul az emberi tesztek alkalmával törekedni kell a „tipikus” alanyok vizsgálatára. Gyakorlatilag kizárható, hogy valaki például engedélyt kapjon gyermekeken való kísérletezésre, holott a fejlődő szervezet sok hatásra köztudottan másként reagál, így felnőtteken kipróbálva egy adott gyermekeknek szánt készítményt, az eltérő eredményeket is szolgáltathat.
 Mi lenne hát az ideális megoldás? Ha kockázatmentesen lehetne próbára tenni az új anyagokat az élő emberi szervezetben. Ezt ugyan nem tehetjük meg, de a Harvard Egyetem Wyss Institute for Biologically Inspired Engineering részlegén dolgozó kutatóknak hála létrehozhatunk egy olyan „tesztpályát”, ami a megszólalásig hasonlít az éles bevetés helyszínére. Elképesztő módon mindezt egy mikrochipre emlékeztető, mindössze néhány centiméteres lapkára rá lehet építeni! A képen látható eszközön egy tüdő modellje található, benne élő sejtekkel. Nézzük, hogyan is épül fel maga a berendezés.
Mi lenne hát az ideális megoldás? Ha kockázatmentesen lehetne próbára tenni az új anyagokat az élő emberi szervezetben. Ezt ugyan nem tehetjük meg, de a Harvard Egyetem Wyss Institute for Biologically Inspired Engineering részlegén dolgozó kutatóknak hála létrehozhatunk egy olyan „tesztpályát”, ami a megszólalásig hasonlít az éles bevetés helyszínére. Elképesztő módon mindezt egy mikrochipre emlékeztető, mindössze néhány centiméteres lapkára rá lehet építeni! A képen látható eszközön egy tüdő modellje található, benne élő sejtekkel. Nézzük, hogyan is épül fel maga a berendezés.
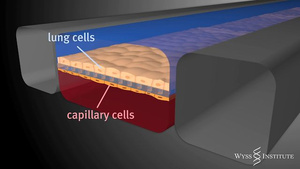 A parányi csatornákat egy vékony, részben átjárható membránnal választják ketté. A membrán egyik felére tüdő sejteket visznek fel, a másikra pedig az érkapilláris sejtjeit. Az így létrejövő két csatornában aztán a valós környezetet szimuláló módon lehet levegőt és vért - vagy azt modellező folyadékot - áramoltatni. Nem kell nagyon túlmagyarázni, hogy mindez mennyivel közelebb áll a valós körülményekhez egy Petri-csészében úszó sejthalmaznál. A rendszer tesztelése végett a mérnökök az alsó, véráramot szimuláló csatornába fehérvérsejteket tartalmazó folyadékot juttattak. A fehérvérsejtek vígan áramlottak tova, egészen addig, amíg a tüdőt reprezentáló üregbe el nem kezdtek baktériumokat adagolni, ezzel imitálva egy valós fertőzést. Ekkor az élő szervezethez hasonló módon a fehérvérsejtek érzékelték a betolakodókat, elkezdtek átmászni a membránon található réseken, és megtámadták a betolakodót (lásd: alábbi videó). Bámulatosan élethű szituáció, mindez egy kis lapka belsejében, a valós szereplők részvételével!
A parányi csatornákat egy vékony, részben átjárható membránnal választják ketté. A membrán egyik felére tüdő sejteket visznek fel, a másikra pedig az érkapilláris sejtjeit. Az így létrejövő két csatornában aztán a valós környezetet szimuláló módon lehet levegőt és vért - vagy azt modellező folyadékot - áramoltatni. Nem kell nagyon túlmagyarázni, hogy mindez mennyivel közelebb áll a valós körülményekhez egy Petri-csészében úszó sejthalmaznál. A rendszer tesztelése végett a mérnökök az alsó, véráramot szimuláló csatornába fehérvérsejteket tartalmazó folyadékot juttattak. A fehérvérsejtek vígan áramlottak tova, egészen addig, amíg a tüdőt reprezentáló üregbe el nem kezdtek baktériumokat adagolni, ezzel imitálva egy valós fertőzést. Ekkor az élő szervezethez hasonló módon a fehérvérsejtek érzékelték a betolakodókat, elkezdtek átmászni a membránon található réseken, és megtámadták a betolakodót (lásd: alábbi videó). Bámulatosan élethű szituáció, mindez egy kis lapka belsejében, a valós szereplők részvételével!
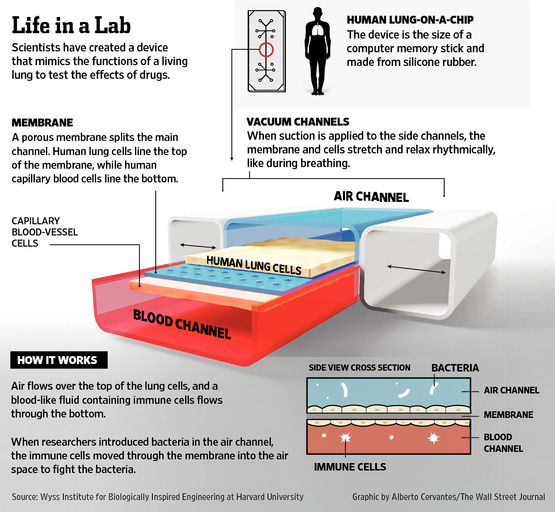
Ezzel azonban még nincs vége a történetnek! Láthatjuk, hogy a membrános csatornát oldalról két másik egység határolja. Ezek a rugalmas falú csövek szívás hatására megváltoztatják az alakjukat és ezzel megnyújtják a hozzájuk kapcsolt membránt az arra tapadó sejtekkel együtt. A „mikrotüdőnk” ezzel elkezd a légzéshez hasonló módon tágulni és szűkülni.
Elsőre nehéz érezni, hogy mindez miért lehet fontos, egy látványos példa azonban rögvest megvilágítja a dolog jelentőségét. Egy rákos betegek esetében alkalmazott gyógyszer ismert mellékhatása, hogy tüdő ödémát okozhat. Ez azt jelenti, hogy az érből folyadék szivárog át a tüdőbe. Amikor a mozgatást kikapcsolva tesztelték az anyagot, akkor ez a szivárgás szinte alig volt érzékelhető, nem okozott különösebben komoly problémát. Ezzel szemben a légző mozgást imitálva a tüdőbe kerülő folyadék mennyisége megháromszorozódott, és a csatorna rövid idő alatt megtelt, jelezve az ödéma kialakulását (a második videón 2:50-től látható a jelenség).
Mint ahogy arra Geraldine Hamilton az előadásában rámutat, nem a tüdő az egyetlen szerv, amelyet így modellezhetünk. Már jelenleg is elérhető a lapkába épített máj, gyomor vagy éppen vese. Ha pedig ezeket összekötjük, akkor egészen bonyolult szituációk is modellezhetővé válnak, egy füst alatt vizsgálhatóak a különböző szervekre gyakorolt hatások. Olyan eszköz ez, amellyel a lehetséges váratlan mellékhatások száma jelentősen csökkenthető.
Az élő környezet ilyen módon történő szimulálása óriási áttörést jelenthet az orvostudomány számára. Ennél már csak az lehetne jobb, ha az adott páciensen, személyre szólóan lehetne tesztelni a hatóanyagokat, hiszen mindenki kicsit másként reagál azokra, néhány kirívó esetben pedig egészen extrémek is lehetnek a kiváltott hatások. Mindez nem álom, tulajdonképpen már jelenleg is a kezünkben van minden olyan technika, amely szükséges ehhez. Akár egy hámsejtet is vissza tudunk programozni őssejt állapotba, amelyből aztán legyártható az éppen szükséges érfalat alkotó sejt, vagy tüdőt felépítő társaik. (Ez képezi a regeneratív orvostudomány alapjait is.) A chip így személyre szabhatóvá válik, a saját sejtjeinkkel azonosakon lehet kipróbálni a megfelelő orvosságokat, mindezt egészségügyi kockázat nélkül! Az eszköz ráadásul könnyen és gyorsan legyártható néhány nagyszerű mérnöki megoldásnak köszönhetően.
|
Források |






